Hacía tiempo que no escribía y quería añadir una entrada sencilla, esta vez explicaré sin entrar en detalles excesivos el Potencial hidrógeno, mas conocido como pH.
El concepto pH fue introducido por el químico danés Søren Peder Lauritz Sørensen en 1909.
El pH mide la actividad del ión hidrógeno (en una disolución acuosa este ión es descrito como hidronio: H3O+ , que también puede darse de las formas H5O2+, H7O3+ and H9O4+ ).
Así la fórmula genérica que se proporciona para el cálculo del pH es la siguiente:
Considerándose pH ácido (alta concentración de iones hidrógeno) si el valor es menor de 7, neutro si es 7 (el pH del agua destilada), o alcalino si es mayor de 7.
No tiene unidad de medida, aunque, por ejemplo un valor de 7, significa en una escala logarítmica una concentración de 10-7 moles por litro de iones hidrógeno.
Hoy en día la medición del pH es muy importante en multitud de campos como la Medicina, Biología, Química, Agricultura, Forestal, Silvicultura, Alimentación, Medio Ambiente, Oceonagrafía, Ingeniería Civil, etc.
Así, por ejemplo, la acidez o alcalinidad de la humedad en la tierra es una propiedad muy importante en la agricultura, porque determinará qué plantas y bacterias crecerán. En particular, para el cultivo de alimentos es preferible una tierra neutra o ligéramente ácida.
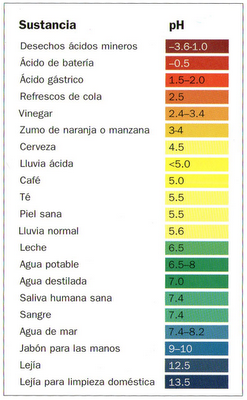
Por último comentar que es relativamente fácil conocer el pH de una solución utilizando un papel tornasol, que contiene un tinte soluble en agua (el tornasol) extraído de ciertos líquenes, y cambia de color en contacto con distinto grado de pH, así mayor acidez pasaria a rojo / granate, neutro verde, y mayor alcalinidad azul oscuro / púrpura. Como puede verse en el siguiente gráfico:
Referencias:
- Metrum, la historia de las medidas, 2007


No hay comentarios:
Publicar un comentario