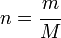Me propuse completar el año 2013 con un post mensual, y el presente da por cumplida la proposición.
Una de las mayores necesidades a lo largo de la historia era medir la misma cantidad de dos sustancias químicas, para ello se necesitaba un patrón de referencia.
Se necesitaba contar el número de átomos o moléculas, y, dado que es imposible contar individualmente las
partículas de una muestra, esto llevó a desarrollar métodos para
determinar estas cantidades de manera rápida y sencilla.
Se han usado muchos patrones de referencia basados en la masa, pero ninguno tan preciso desde que en el S. XIX, el científico italiano Amedeo Avogadro planteara la - desde entonces probada - hipótesis de que volúmenes iguales de gases, a la misma temperatura y presión, contienen el mismo número de moléculas.
 |
| Amadeo Avogadro |
Por tanto, es posible pesar un volumen dado de hidrógeno (H2) con una masa atómica aproximada de 1 u (unidad de masa atómica unificada (unidad obsoleta)), y compararlo con el peso del mismo volumen de oxígeno en las mismas condiciones y calcular la masa atómica del oxígeno (casi 16 u).
Se definieron los términos equivalente, átomo-gramo, molécula-gramo, fórmula-gramo, etc. Actualmente estos términos no se usan y han sido sustituidos por el mol.
Más adelante el mol queda determinado como el número de moléculas H2 existentes en dos gramos de hidrógeno, lo que da el peculiar número de 6,022 141 29 (30) × 1023 al que se conoce como número de Avogadro.
Un mol (unidad básica del SI) es la masa atómica de una sustancia en gramos, y siempre contiene el mismo número de átomos o moléculas de esa sustancia concreta.
Según la RAE: mol: Unidad mínima de una sustancia que conserva sus propiedades químicas. Puede estar formada por átomos iguales o diferentes.
Un mol es una de las 7 unidades básicas del Sistema Internacional, y se usa para medir la cantidad de sustancia.
Dada cualquier sustancia (elemento o compuesto químico)
y considerando a la vez un cierto tipo de entidades elementales que la
componen, se define como un mol a la cantidad de esa sustancia que
contiene tantas entidades elementales del tipo considerad. Por ejemplo: la masa atómica del carbono es 12, de forma que un mol de carbono pesa 12 gramos.
El número de unidades elementales –átomos, moléculas, iones, electrones, radicales
u otras partículas o grupos específicos de éstas– existentes en un mol
de sustancia es, por definición, una constante que no depende del
material ni del tipo de partícula considerado. Esta cantidad es llamada número de Avogadro (NA) y equivale a:
1 mol = 6,022 141 29 (30) × 1023 unidades elementales
Por último, comentar algunos datos técnicos:
1 mol de gas ideal ocupa un volumen de 22,4 L a 0 °C de temperatura y 1 atm de presión; y de 22,7 L si la presión es de 1 bar (0,9869 atm).
El número n de moles de átomos (o de moléculas si se trata de un compuesto) presentes en una cantidad de sustancia de masa m, es:
Referencias
- La medida de todas las cosas